
上海奧法美嘉生物科技有限公司
 鉆石會(huì)員
鉆石會(huì)員 已認(rèn)證
已認(rèn)證


中國(guó)粉體網(wǎng)認(rèn)證電話,請(qǐng)放心撥打

上海奧法美嘉生物科技有限公司
 鉆石會(huì)員
鉆石會(huì)員 已認(rèn)證
已認(rèn)證
復(fù)雜制劑應(yīng)用專題 | AccuSizer在疫苗研發(fā)與質(zhì)控中的應(yīng)用:亞可見(jiàn)顆粒的精準(zhǔn)檢測(cè)
介紹
本文隸屬于復(fù)雜制劑應(yīng)用專題,全文共 7076 字,閱讀大約需要 18 分鐘
摘要:疫苗中亞可見(jiàn)顆粒的存在對(duì)產(chǎn)品的安全性、有效性及質(zhì)量一致性具有重要影響。這些顆粒可能來(lái)源于蛋白質(zhì)聚集、乳化劑聚集或外源性微粒,盡管尺寸處于亞可見(jiàn)范圍,仍可能誘發(fā)免疫反應(yīng)或注射部位不良反應(yīng)。由于亞可見(jiàn)顆粒粒徑小、來(lái)源復(fù)雜、濃度低且易受配方干擾,傳統(tǒng)檢測(cè)手段難以實(shí)現(xiàn)準(zhǔn)確量化。AccuSizer顆粒計(jì)數(shù)器憑借高靈敏度、寬動(dòng)態(tài)范圍、高分辨率和快速測(cè)量的優(yōu)勢(shì),能夠有效解決疫苗亞可見(jiàn)顆粒檢測(cè)中的關(guān)鍵難題,為疫苗研發(fā)、質(zhì)量控制及法規(guī)符合提供可靠工具。本文系統(tǒng)分析了亞可見(jiàn)顆粒的特性及其對(duì)疫苗質(zhì)量的影響,總結(jié)了檢測(cè)難點(diǎn),并探討了AccuSizer在相關(guān)應(yīng)用中的優(yōu)勢(shì)與實(shí)踐案例。
關(guān)鍵詞:疫苗;顆粒檢測(cè);AccuSizer;亞可見(jiàn)顆粒
一、疫苗及顆粒概述
1.1 疫苗的類型
疫苗是一類用于預(yù)防感染性疾病的生物制品,其通過(guò)激發(fā)機(jī)體特異性免疫應(yīng)答獲得免疫保護(hù)。按照制備原理的不同,常見(jiàn)的疫苗類型包括:
滅活疫苗:通過(guò)化學(xué)或物理方法滅活病原體,如滅活流感疫苗
減毒活疫苗:通過(guò)削弱病原體毒力制備,如麻疹疫苗
重組蛋白疫苗:利用重組技術(shù)表達(dá)特定抗原蛋白,如乙型肝炎疫苗
核酸疫苗:基于mRNA或DNA表達(dá)抗原蛋白,如部分新冠疫苗
不同類型疫苗中蛋白質(zhì)含量、輔料成分和佐劑配比差異明顯,這直接影響顆粒形成和分布特性。
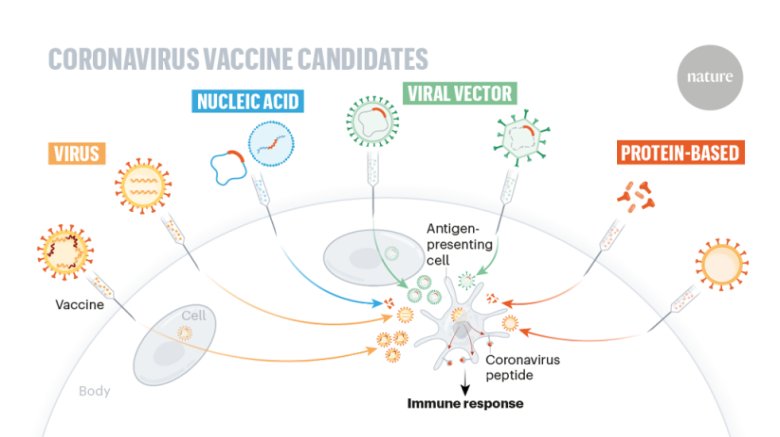
圖2:蛋白質(zhì)不同聚集狀態(tài)的示意圖
1.2 疫苗中顆粒的來(lái)源
疫苗中的顆粒來(lái)源復(fù)雜,可依據(jù)不同劃分原則進(jìn)行分類。按粒徑范圍,通常分為可見(jiàn)顆粒與亞可見(jiàn)顆粒;按來(lái)源,則可分為內(nèi)源性顆粒與外源性顆粒。
1.2.1 內(nèi)源性顆粒
內(nèi)源性顆粒主要源于疫苗配方自身成分的理化變化。典型例子有蛋白質(zhì)聚集體和乳化劑顆粒。
1.2.1.1蛋白質(zhì)聚集體
蛋白質(zhì)類疫苗在生產(chǎn)、運(yùn)輸及儲(chǔ)存過(guò)程中極易受到物理、化學(xué)因素的影響,如溫度波動(dòng)、凍融循環(huán)以及pH變化等。這些應(yīng)激條件會(huì)導(dǎo)致蛋白質(zhì)分子部分折疊或發(fā)生不可逆聚集,進(jìn)而形成不同尺寸范圍的亞可見(jiàn)顆粒(subvisible particles, SVPs)[2,3]。如圖2展示了蛋白質(zhì)在受到外界因素影響時(shí),其結(jié)構(gòu)變化形成蛋白質(zhì)聚集體的過(guò)程。從初始的折疊、有序的蛋白質(zhì)結(jié)構(gòu)開(kāi)始,經(jīng)過(guò)一系列中間狀態(tài),最終形成不同形式的聚集體。這一過(guò)程直觀地呈現(xiàn)了蛋白質(zhì)類疫苗在不利環(huán)境下可能發(fā)生的結(jié)構(gòu)改變,這些改變正是導(dǎo)致顆粒形成的原因。研究表明,這類顆粒不僅會(huì)降低疫苗制劑的長(zhǎng)期穩(wěn)定性,還可能增強(qiáng)其免疫原性,誘導(dǎo)機(jī)體產(chǎn)生非預(yù)期的免疫反應(yīng)甚至免疫原性相關(guān)不良事件[4]。這些顆粒可能引起免疫原性增加或降低疫苗穩(wěn)定性,對(duì)其進(jìn)行有效監(jiān)測(cè)和表征對(duì)于保證疫苗的安全性和療效至關(guān)重要。
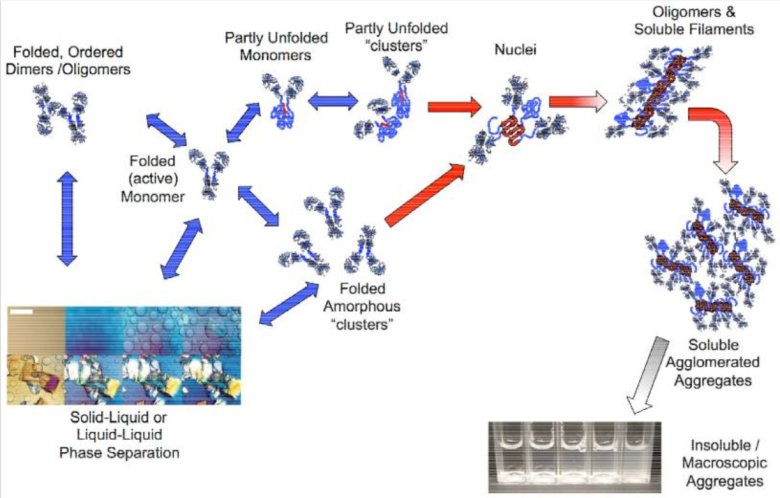
圖2:蛋白質(zhì)不同聚集狀態(tài)的示意圖
1.2.1.2 乳化劑顆粒
油包水乳液型佐劑(如MF59、AS03)中的乳劑顆粒本身屬于功能性成分,通常處于亞微米級(jí)別,對(duì)疫苗的免疫增強(qiáng)效果具有重要作用。然而,在貯存或運(yùn)輸過(guò)程中,乳劑顆粒可能發(fā)生聚集或粒徑異常增大,形成亞可見(jiàn)或不溶性大顆粒,進(jìn)而影響制劑的物理穩(wěn)定性與用藥安全性。若顆粒過(guò)大,易導(dǎo)致乳劑分層、聚集,并增加注射部位的不良反應(yīng)風(fēng)險(xiǎn);而顆粒尺寸若偏離預(yù)期范圍過(guò)小,則可能引起體內(nèi)快速清除或免疫應(yīng)答不足,均會(huì)削弱疫苗的有效性與安全性。以諾華乳佐劑專利(WO2011067669A2)為例,其中明確指出需對(duì)粒徑在1.2 μm以上的顆粒進(jìn)行監(jiān)控與定量分析,并制定了相應(yīng)的測(cè)量標(biāo)準(zhǔn)。該專利采用AccuSizer系列顆粒計(jì)數(shù)器進(jìn)行檢測(cè),正是基于對(duì)大顆粒影響乳劑穩(wěn)定性的考量。此類大顆粒的存在可能加劇聚集與分層現(xiàn)象,從而影響佐劑免疫效果的一致性與安全性[5]。該實(shí)例表明,AccuSizer在乳劑體系中對(duì)亞可見(jiàn)及不溶性大顆粒的高精度監(jiān)測(cè)具有明確的應(yīng)用價(jià)值。

圖3:諾華乳佐劑專利
1.2.2 外源性微粒
疫苗中的外源性微粒來(lái)源復(fù)雜,可能在生產(chǎn)、包裝、運(yùn)輸、儲(chǔ)存、開(kāi)啟及臨床使用的各個(gè)環(huán)節(jié)被引入。這進(jìn)一步強(qiáng)調(diào)了嚴(yán)格控制微粒污染的必要性,以及在藥品包裝設(shè)計(jì)、操作流程規(guī)范和終端臨床使用中采取系統(tǒng)性風(fēng)險(xiǎn)控制措施的重要性。
圖4:可能引入外源性微粒途徑示意圖
案例分享:安瓿瓶不同打開(kāi)方式與藥品微粒含量實(shí)驗(yàn)及其結(jié)果;該實(shí)驗(yàn)設(shè)置了三種不同的安瓿瓶打開(kāi)方式作為研究變量,分別Our Method、常General Method以及Open adaptor。實(shí)驗(yàn)過(guò)程中,嚴(yán)格遵循標(biāo)準(zhǔn)操作流程,實(shí)驗(yàn)結(jié)果通過(guò)柱狀圖清晰呈現(xiàn)。

圖5:安瓿瓶不同打開(kāi)方式操作示意圖
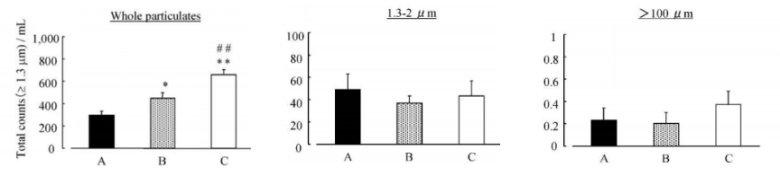
圖6:安瓿瓶A、B、C三種打開(kāi)方式藥品微粒含量對(duì)比
從圖示結(jié)果可以看出,安瓿瓶玻璃在受力斷裂時(shí),無(wú)論是使用開(kāi)瓶器還是直接用手掰開(kāi)安瓿瓶,都會(huì)在開(kāi)啟過(guò)程中產(chǎn)生數(shù)量不等的微粒。
這些外源顆粒的存在給疫苗注射安全埋下了隱患,可能致使接種部位出現(xiàn)刺激癥狀、引發(fā)炎癥等不良后果。[6]
二、為什么需要關(guān)注疫苗中的顆粒
2.1. 對(duì)健康與免疫的影響
健康風(fēng)險(xiǎn)是疫苗安全性關(guān)注的核心。研究表明,疫苗用輔料(如蔗糖)中若存在不溶性微粒,可能激發(fā)異常的免疫應(yīng)答。例如,基于小鼠腘窩淋巴結(jié)模型的實(shí)驗(yàn)顯示,蔗糖中的不溶性微粒可引發(fā)免疫反應(yīng),提示在疫苗輔料的質(zhì)量控制中需重視不溶性微粒的合理管控。[6]正常情況下,疫苗注射后機(jī)體會(huì)產(chǎn)生預(yù)期的免疫應(yīng)答并伴隨一些輕微、正常的生理反應(yīng),但也可能出現(xiàn)異常情況。圖7直觀對(duì)比疫苗注射后機(jī)體的正常反應(yīng)與異常反應(yīng):左側(cè)顯示注射后局部組織無(wú)異常炎癥表現(xiàn),僅產(chǎn)生預(yù)期免疫應(yīng)答和組織相關(guān)的輕微、正常生理反應(yīng);右側(cè)顯示可能會(huì)產(chǎn)生的血管栓塞風(fēng)險(xiǎn)、組織反應(yīng)異常、過(guò)敏反應(yīng)等伴隨的異常病理反應(yīng)。隨著微粒進(jìn)入機(jī)體循環(huán),還可能引起更大的全身健康風(fēng)險(xiǎn),如圖8所示。[7]
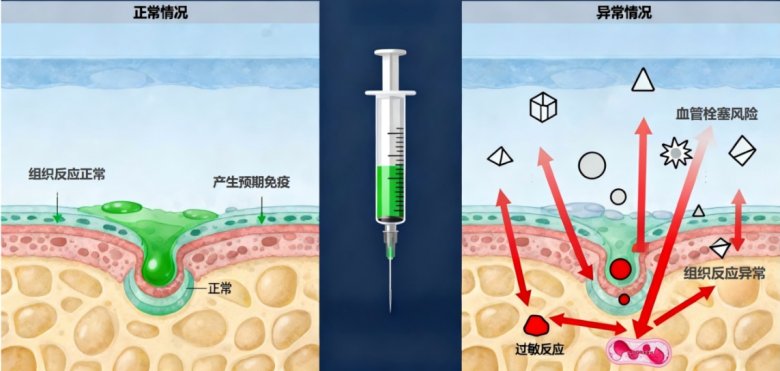
圖7:注射疫苗免疫反應(yīng)對(duì)比圖
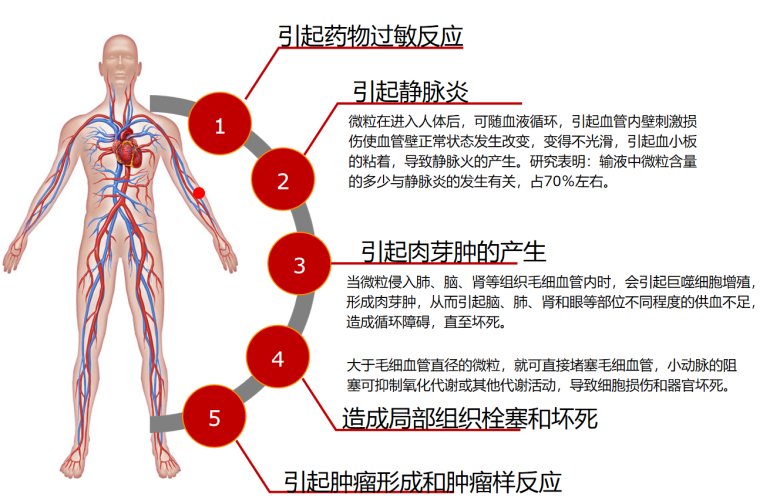
圖8:微粒引起健康風(fēng)險(xiǎn)圖示
2.2 疫苗有效性與制劑穩(wěn)定性
疫苗中含有多種成分,其中不少是以蛋白質(zhì)為基礎(chǔ)的物質(zhì),抗原便是典型的蛋白質(zhì)成分。在疫苗的研發(fā)、生產(chǎn)和儲(chǔ)存過(guò)程中,由于各種因素(如溫度變化、pH 值波動(dòng)、機(jī)械應(yīng)力等)的影響,抗原蛋白質(zhì)可能會(huì)發(fā)生聚集現(xiàn)象。蛋白質(zhì)聚集可能改變抗原構(gòu)象,降低疫苗誘導(dǎo)的特異性免疫應(yīng)答。乳化劑顆粒分布不均則可能導(dǎo)致佐劑作用不穩(wěn)定,影響免疫增強(qiáng)效果。[8]
如圖9所示:左側(cè)展示了典型的Y形抗體分子結(jié)構(gòu),正常情況下,其兩個(gè)臂端可與特定抗原實(shí)現(xiàn)特異性結(jié)合,這是啟動(dòng)正常免疫應(yīng)答的關(guān)鍵步驟。然而,右側(cè)呈現(xiàn)了抗原發(fā)生蛋白聚集后的狀態(tài),大量抗原聚集形成較大的聚集體。這種聚集改變了抗原的原有結(jié)構(gòu)和表位暴露情況,導(dǎo)致抗體無(wú)法與聚集后的抗原進(jìn)行有效結(jié)合。一旦無(wú)法實(shí)現(xiàn)特異性結(jié)合,正常的免疫應(yīng)答過(guò)程便無(wú)法啟動(dòng),在疫苗應(yīng)用的情境下,也就意味著疫苗無(wú)法發(fā)揮預(yù)期的免疫效果,影響了其保護(hù)機(jī)體免受相應(yīng)病原體侵害的能力。因此,對(duì)亞可見(jiàn)顆粒進(jìn)行精確監(jiān)控是保證疫苗免疫效果的關(guān)鍵環(huán)節(jié)。
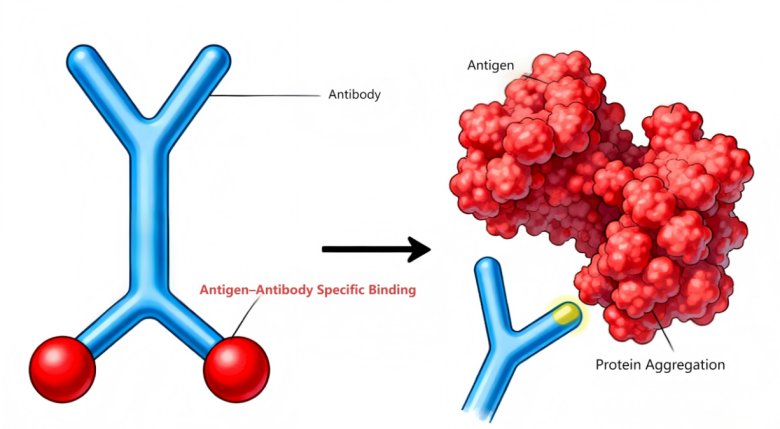
圖9:抗原抗體正常特異性結(jié)合及蛋白聚集導(dǎo)致的異常結(jié)合示意圖
2.3 監(jiān)管需求
疫苗投入市場(chǎng)前,企業(yè)完成全部檢驗(yàn)項(xiàng)目后,必須由國(guó)家藥品監(jiān)管部門(mén)對(duì)每批疫苗的質(zhì)量進(jìn)行嚴(yán)格審核、檢驗(yàn)。企業(yè)的質(zhì)量自檢旨在確保疫苗的安全、有效、合規(guī),涵蓋從原料到成品的每個(gè)環(huán)節(jié),通過(guò)嚴(yán)格的質(zhì)量控制,保障疫苗質(zhì)量符合國(guó)家標(biāo)準(zhǔn)。[9]
我國(guó)自 2006 年開(kāi)始對(duì)進(jìn)口 MMR 制品實(shí)行批簽發(fā)全檢,2008 年開(kāi)始對(duì)國(guó)產(chǎn) MMR 制品實(shí)行批簽發(fā)資料審核與實(shí)驗(yàn)室項(xiàng)目部分檢定。中國(guó)無(wú)進(jìn)口MMR 制品后,國(guó)產(chǎn) MMR 疫苗的批簽發(fā)數(shù)量明顯增加,見(jiàn)圖10。[10]
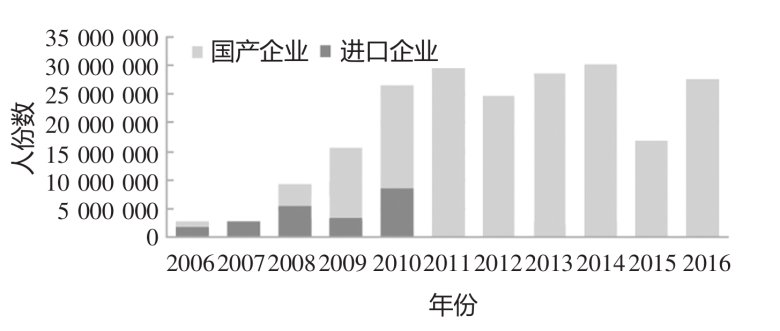
圖 10:2006~2016 年間 MMR 疫苗批簽發(fā)人份數(shù)統(tǒng)計(jì)
疫苗產(chǎn)量的大規(guī)模提升對(duì)疫苗的質(zhì)量提出了嚴(yán)峻的考驗(yàn),維持疫苗的批間穩(wěn)定性與一致性是保證疫苗有效性與安全性的關(guān)鍵。
2.4 法規(guī)要求
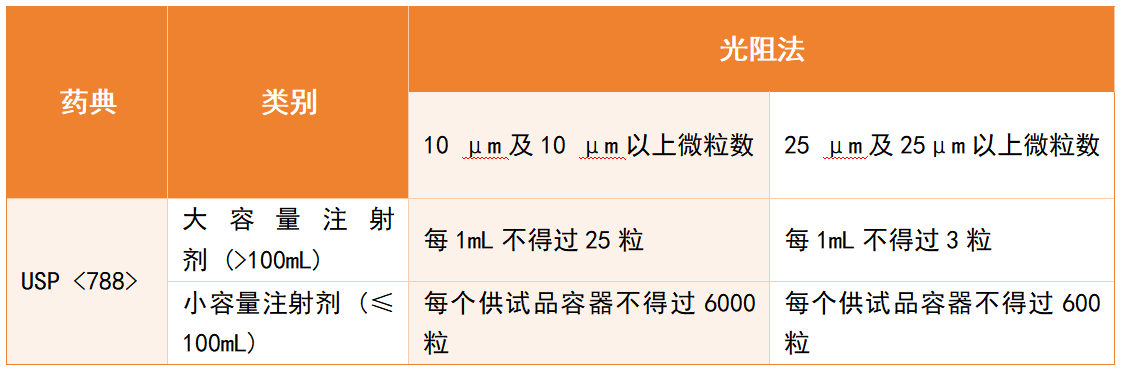
各國(guó)藥典對(duì)注射劑中的微粒均有嚴(yán)格要求,但檢測(cè)范圍和限值存在差異。以注射劑中不溶性微粒為例:美國(guó)藥典USP <788> 對(duì)注射劑≥10 μm和≥25 μm的顆粒設(shè)定了明確限值,見(jiàn)表格1。中國(guó)藥典(ChP):對(duì)不溶性微粒的檢測(cè)范圍相對(duì)較窄,主要針對(duì)部分常規(guī)注射劑,對(duì)特定類型疫苗或含佐劑的復(fù)雜制劑尚未完全涵蓋。雖藥典規(guī)定的“不溶性微粒”檢測(cè)僅覆蓋部分注射制劑,并非涵蓋所有類型的疫苗;但在疫苗研發(fā)與質(zhì)量控制實(shí)踐中,企業(yè)已普遍將微粒監(jiān)測(cè)納入關(guān)鍵檢測(cè)項(xiàng)目。這一趨勢(shì)正好反映了從“科學(xué)風(fēng)險(xiǎn)”到“法規(guī)要求”的轉(zhuǎn)化過(guò)程。[11][12]
表格1:USP <788>關(guān)于注射劑規(guī)定
三、疫苗顆粒檢測(cè)的難點(diǎn)
疫苗顆粒的物理化學(xué)特性會(huì)影響其穩(wěn)定性、免疫原性和安全性。然而,疫苗制劑中顆粒體系的復(fù)雜性以及檢測(cè)環(huán)境的敏感性使得精準(zhǔn)表征疫苗顆粒面臨多重技術(shù)挑戰(zhàn)。以下從顆粒來(lái)源、濃度、配方干擾及樣品制備四個(gè)維度,分析疫苗顆粒檢測(cè)的難點(diǎn)。
3.1 顆粒來(lái)源復(fù)雜
疫苗制劑中顆粒來(lái)源多樣,可分為內(nèi)源性顆粒和外源性顆粒兩大類。不同來(lái)源的顆粒可能具有相似的粒徑或光學(xué)特性,但其潛在風(fēng)險(xiǎn)截然不同。這對(duì)檢測(cè)儀器的分辨率、檢測(cè)原理的針對(duì)性以及數(shù)據(jù)分析能力提出了極高要求。
3.2 樣品有限下的微量顆粒檢測(cè)難
在疫苗研發(fā)階段,可用于顆粒檢測(cè)的樣品通常非常有限,尤其是臨床前或早期研發(fā)樣品,無(wú)法進(jìn)行大規(guī)模取樣。這就對(duì)檢測(cè)儀器提出了高要求:必須具備高靈敏度、低樣品消耗和精確量化能力,才能在微量樣品條件下準(zhǔn)確監(jiān)測(cè)顆粒,避免漏檢或誤判。
3.3 配方干擾
高蛋白濃度、鹽類或乳化劑可能影響光學(xué)或阻抗檢測(cè)信號(hào),導(dǎo)致假陽(yáng)性或假陰性結(jié)果,給檢測(cè)帶來(lái)挑戰(zhàn)。
3.4 樣品制備易改變顆粒狀態(tài)
稀釋、攪拌或溫度變化可能導(dǎo)致顆粒聚集或解聚,影響測(cè)量結(jié)果的準(zhǔn)確性。因此,減少樣品制備干擾是確保檢測(cè)可靠性的關(guān)鍵。
四、AccuSizer在疫苗顆粒檢測(cè)中的優(yōu)勢(shì)
疫苗顆粒檢測(cè)面臨多重挑戰(zhàn),包括顆粒微小、濃度低、來(lái)源復(fù)雜、配方干擾以及法規(guī)要求嚴(yán)格。AccuSizer顆粒計(jì)數(shù)器在應(yīng)對(duì)這些難點(diǎn)時(shí)具有多方面優(yōu)勢(shì),可以分為以下幾點(diǎn):
4.1 微量進(jìn)樣
疫苗樣品在研發(fā)、生產(chǎn)及質(zhì)量控制過(guò)程中,有時(shí)可獲取的樣品體積較小。AccuSizer靈敏度高達(dá)10PPT級(jí)別,即使只有微量的顆粒通過(guò)傳感器,也可以精準(zhǔn)檢測(cè)出來(lái)。確保即使在樣品量有限的情況下,也能全面評(píng)估疫苗的安全性和穩(wěn)定性,避免因漏檢微量顆粒而影響疫苗質(zhì)量
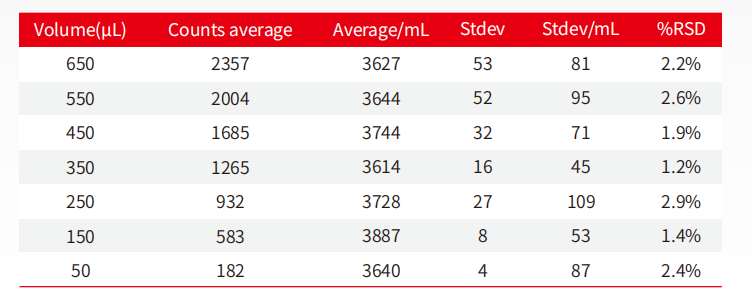
圖11:微量進(jìn)樣不同體積精確性對(duì)比表
新版藥典USP<787>對(duì)于體積精度提出了苛刻的要求。AccuSizer 系列儀器對(duì)進(jìn)樣體積、流速及計(jì)數(shù)準(zhǔn)確性分辨率經(jīng)過(guò)嚴(yán)格驗(yàn)證,最小的進(jìn)樣量可達(dá)50μL(依不同配置)。
從表中數(shù)據(jù)可以發(fā)現(xiàn),從650μL至50μL所檢測(cè)的不同體積中,所得到的每毫升的顆粒數(shù)基本相同,其RSD值在50uL處依舊維持在2.4%,可見(jiàn)AccuSizer系列儀器在微量進(jìn)樣的技術(shù)層面,依然可以提供精確的數(shù)據(jù)。
4.2 寬高濃度適應(yīng)能力
AccuSizer系列顆粒計(jì)數(shù)器專為高濃度樣本的檢測(cè)提供解決方案。其獨(dú)特的設(shè)計(jì)理念特別適合高濃度樣本,搭配自動(dòng)稀釋模塊更是可以檢測(cè)濃度高達(dá)1012#/mL的樣本。這使其適用于顆粒濃度變化較大的疫苗樣品,包括部分乳佐劑制劑。
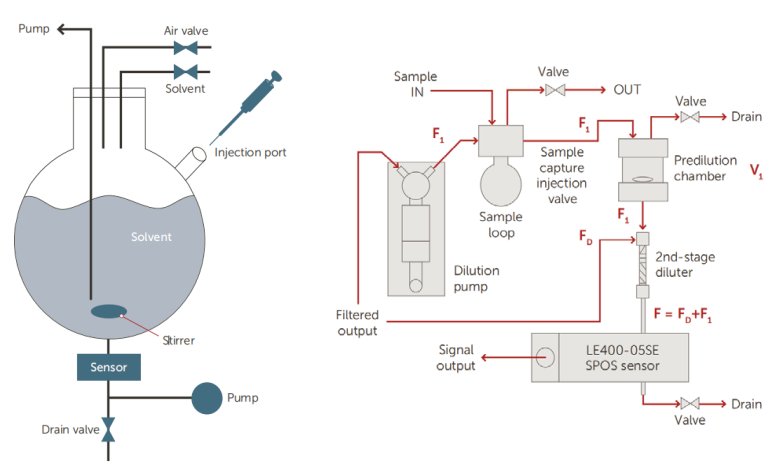
圖 12:自動(dòng)稀釋系統(tǒng)原理圖 圖13:二步稀釋系統(tǒng)原理圖
如圖14所示AccuSizer系列顆粒計(jì)數(shù)器(分別應(yīng)對(duì)LE、FX、Fxnano傳感器)測(cè)試數(shù)據(jù)結(jié)果,A7000 APS結(jié)果圖(LE傳感器)濃度高達(dá): 3.72E+007 顆/mL。
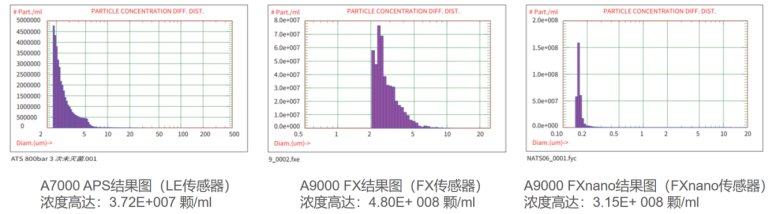
圖14:AccuSizer系列(分別應(yīng)對(duì)LE、FX、Fxnano傳感器)測(cè)試數(shù)據(jù)結(jié)果
4.3 測(cè)試結(jié)果準(zhǔn)確可靠
在高蛋白、高鹽或乳化劑復(fù)雜體系中,AccuSizer通過(guò)單顆粒光學(xué)傳感計(jì)數(shù)(Single Particle Optical Sizing,SPOS),可實(shí)現(xiàn)對(duì)分散體系中的不溶物微粒量化計(jì)數(shù),減少配方干擾導(dǎo)致的假信號(hào)。這對(duì)于保證結(jié)果準(zhǔn)確性和重復(fù)性至關(guān)重要。
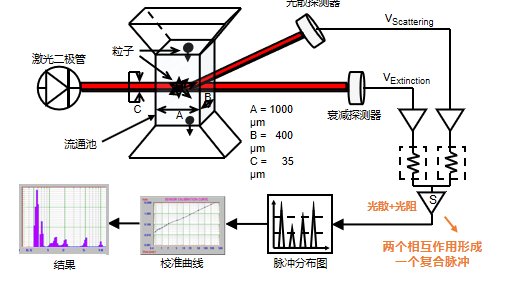
圖15:SPOS原理圖
4.4 符合國(guó)際法規(guī)
AccuSizer測(cè)量結(jié)果重復(fù)性高,可追溯性強(qiáng),符合國(guó)內(nèi)外藥典(如USP<788>及中國(guó)藥典2025版)對(duì)亞可見(jiàn)顆粒檢測(cè)的要求,可用于批次間對(duì)比和質(zhì)量控制,為疫苗研發(fā)和生產(chǎn)提供可靠的數(shù)據(jù)支持。

圖16:CP0903 檢測(cè)報(bào)告

圖17:USP788 檢測(cè)報(bào)告
4.5 AccuSizer顆粒計(jì)數(shù)器系列
AccuSizer系列顆粒計(jì)數(shù)器通過(guò)搭配不同傳感器、進(jìn)樣器,適配不同的樣本的測(cè)試需求,能快速而準(zhǔn)確地測(cè)量顆粒粒徑以及顆粒數(shù)量/濃度的卓越伙伴。


總結(jié)
疫苗中的亞可見(jiàn)顆粒是影響其安全性與有效性的關(guān)鍵質(zhì)量屬性。無(wú)論是蛋白質(zhì)抗原的聚集體、乳佐劑的粒度分布,還是包材引入的外源性微粒,均需進(jìn)行精準(zhǔn)監(jiān)控。AccuSizer系列顆粒計(jì)數(shù)器憑借其寬檢測(cè)范圍、高靈敏度及符合國(guó)際標(biāo)準(zhǔn)的檢測(cè)方法,能夠在疫苗研發(fā)、生產(chǎn)、質(zhì)控和穩(wěn)定性研究的各個(gè)階段發(fā)揮作用。未來(lái),隨著疫苗平臺(tái)的不斷更新和監(jiān)管要求的日益嚴(yán)格,AccuSizer將在全球疫苗行業(yè)中繼續(xù)發(fā)揮重要作用,為提升公共衛(wèi)生安全提供技術(shù)保障。
參考文獻(xiàn)
[1]
[2] Sharma DK, King D, Oma P, Merchant C. Micro-Flow Imaging: Flow Microscopy Applied to Sub-Visible Particulate Analysis in Protein Formulations. AAPS J. 2010;12(3):455–64.
[3] European Pharmacopoeia. Sub-visible particulate contamination: Ph. Eur. 10.0, 2.9.19. 2020.
[4] Wang W. Protein aggregation and its inhibition in biopharmaceutics. International Journal of Pharmaceutics. 2005;289(1-2):1–30.
[5] Novartis AG. WO2011067669A2
[6] 王玨,江穎,沈雁,等.基于小鼠腘窩淋巴結(jié)模型對(duì)疫苗用輔料蔗糖中不溶性微粒激發(fā)免疫應(yīng)答風(fēng)險(xiǎn)的評(píng)估[J].藥物生物技術(shù),2022,29(03):234-238.
[7]彭姝,張軍,李慧芬等.輸液中不溶性微粒的危害綜述[J].中國(guó)藥事,2018,32(08):1058-1063.
[8] Rosenberg AS. Effects of protein aggregates: an immunologic perspective. AAPS J. 2006;8(3):E501–E507.
[9] 周雅潔,聶建輝,黃維金,等.國(guó)內(nèi)外疫苗批簽發(fā)管理概述[J].中國(guó)食品藥品監(jiān)管,2025,(02):92-103.
[10] 崔曉雨,李薇,權(quán)婭茹,等.麻腮風(fēng)聯(lián)合減毒活疫苗2014~2016年批簽發(fā)質(zhì)量分析[J].中國(guó)生物制品學(xué)雜志,2017.[11] USP <788>. Particulate matter in injections. 2023.
[12] 中國(guó)藥典2025版. 注射劑不溶性微粒檢測(cè)要求.
相關(guān)產(chǎn)品
更多
相關(guān)文章
更多
技術(shù)文章
2025-08-20技術(shù)文章
2025-08-14技術(shù)文章
2025-04-18技術(shù)文章
2025-04-18
虛擬號(hào)將在 秒后失效
使用微信掃碼撥號(hào)