
諾澤流體科技(上海)有限公司
 白金會員
白金會員 已認證
已認證
一、介紹
本文隸屬于氣流粉碎機&微射流均質機應用專題,全文共15600 字,閱讀大約需要 60 分鐘。
摘要
自上而下粉碎法因其可擴展性及與自下而上法相比更易于商業化實施,被廣泛應用于制藥行業中對原料藥(API)的微粉化。本研究比較了氣流粉碎(干法粉碎)和微射流技術(濕法粉碎)在粉碎吲哚美辛和萘普生中的應用。采用實驗設計(DoE)方法建立了實驗方案,并確定了影響API顆粒平均粒度的關鍵參數。研究目標是通過兩種技術制備具有相同API、輔料組合、濃度和粒度的混懸液,并對所得混懸液的粒度穩定性、固態形式和形態進行了研究。兩種技術均成功制備了粒度在1~10 μm范圍內且為API最穩定固態形式的混懸液。本研究確立了將顆粒粉碎至目標粒度的關鍵參數,以及生產微晶的方案,并重點突出了兩種方法之間的差異。
關鍵詞:
活性藥物成分,氣流粉碎,微射流技術,微晶混懸液,穩定性,實驗設計
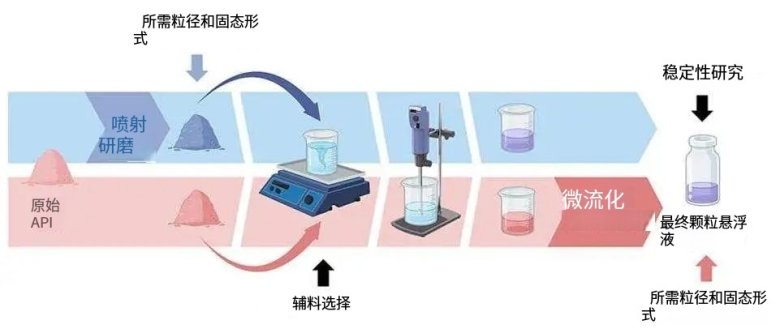
二、整體框架
本篇文章的整體框架如下所示:
三、引言
本研究旨在系統比較干法(氣流粉碎)與濕法(微射流)兩種自上而下技術在制備難溶性藥物(吲哚美辛和萘普生)微粒懸浮液方面的綜合效能。
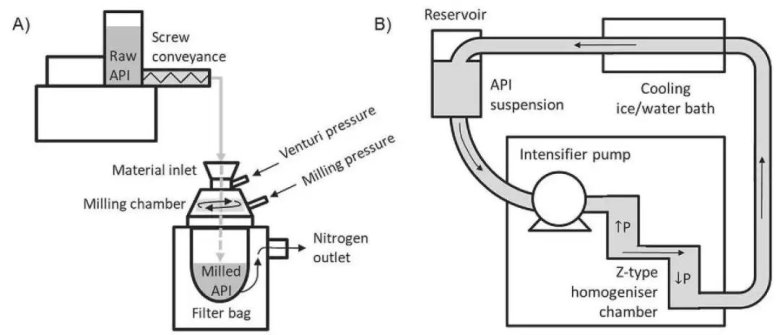
氣流粉碎機和微射流均質機示意圖
通過采用實驗設計(DoE)方法,研究將深入探討不同粉碎機制(干法以碰撞和剪切力為主,濕法疊加空穴效應)對API顆粒關鍵質量屬性的影響,包括:①粒度分布(PSD)的控制精度與穩定性;②多晶型轉化風險與固態形式穩定性;③顆粒形態特征的變化;④長期儲存中的物理穩定性差異。研究結果將為制藥工業中基于產品目標特性(如注射懸浮液的可再分散性、口服制劑的溶出度)科學選擇微粒化技術提供關鍵數據支持,同時建立針對難溶性藥物微粒化的標準化工藝開發路徑。
四、基本流程
使用氣流粉碎技術生產微晶混懸液
粉碎設備
設備: 使用圓盤式氣流粉碎機,以氮氣(N?)作為研磨氣體。
粉碎參數
通過精密給料器控制API物料的進料速率(MFR, 0.5-20 g/min),通過調節氣體流量(GFR, 2.2-9.2 m3/h)來控制研磨壓力。顆粒通過噴嘴加速、在研磨腔內發生碰撞破碎,最終由袋式過濾器收集。
配制方法
方法: 將氣流粉碎得到的API干粉逐步加入到含有穩定劑(10 mg/ml Poloxamer 407 和 20 mg/ml Tween 20)的水溶液中。
分散工藝: 先采用磁力攪拌(1000 rpm, 1小時)進行初步潤濕和分散,再使用高剪切分散均質機(3000 rpm, 2分鐘)進行強力分散,以打碎可能存在的團聚體,最終形成API濃度為200 mg/ml的均勻懸浮液。
樣品儲存
將配制好的懸浮液分裝至玻璃小瓶中,密封后用于后續的穩定性研究。
氣流粉碎過程的實驗變量
使用微射流技術生產微晶混懸液
預處理
先將原料API粉末(吲哚美辛或萘普生)分散在含有穩定劑(10 mg/ml Poloxamer 407 和 20 mg/ml Tween 20)的水溶液中,API濃度為200 mg/ml。
分散過程與氣流粉碎法配液階段一致:先磁力攪拌(1000 rpm, 1h),再高剪切分散(3000 rpm, 2min),以確保初始懸浮液均勻無大團聚體。
微射流均質設備
設備: 微射流均質機高
均質參數
均質壓力:最高壓力30,000 psi(約2000 bar)
交互腔: Z型腔,其最小通道直徑為 87 μm
溫度控制: 使用水/冰浴對物料進行冷卻,嚴格控制入口溫度(10-20°C)和出口溫度(5-15°C),以消除壓產生的高熱對API穩定性的影響
樣品儲存
將配制好的懸浮液分裝至玻璃小瓶中,密封后用于后續的穩定性研究。
顆粒表征
五、結果與討論
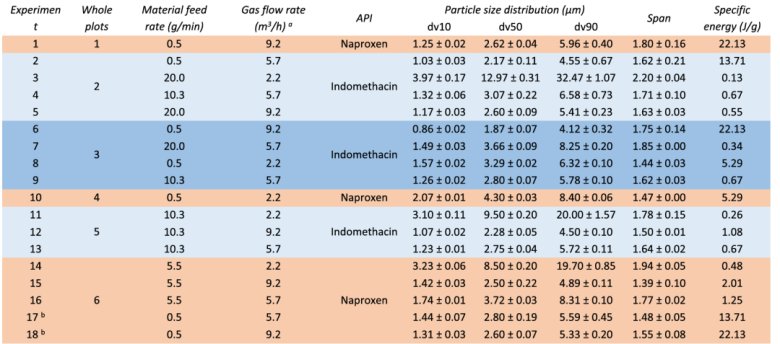
氣流粉碎
成功實現粒度控制:
通過DoE方法,成功將吲哚美辛和萘普生的粒度減小至目標范圍(1-10 μm)。
實驗參數范圍:物料進料速率(MFR)為 0.5-20 g/min,氣體流量(GFR)為 2.2-9.2 m3/h。
關鍵工藝參數: 統計分析表明,GFR(負相關)和 MFR(正相關) 對中值粒徑(dv50)有最顯著的線性影響,兩者的交互作用也極為重要。而API種類本身的影響在統計上不顯著。
能量與粒度的關系: 在低MFR(0.5 g/min)和高GFR(9.2 m3/h) 的組合下(即高比能量輸入),獲得了最細的顆粒(如實驗1, 6, 18)。反之,高MFR和低GFR(低比能量)則導致研磨不充分(如實驗3, 11, 14)。
形態與固態形式: SEM顯示研磨后顆粒形態變得不規則,但與原料相比,DSC和XRPD證實即使在高能量輸入下也未發生無定形化或多晶型轉變,成功保持了API最穩定的晶型。

萘普生和吲哚美辛在氣流粉碎前后的SEM圖像,氣流粉碎在氣體流速為9.2m3/h(6.6bar) 和質量進料速率為0.5 g/min的條件下進行
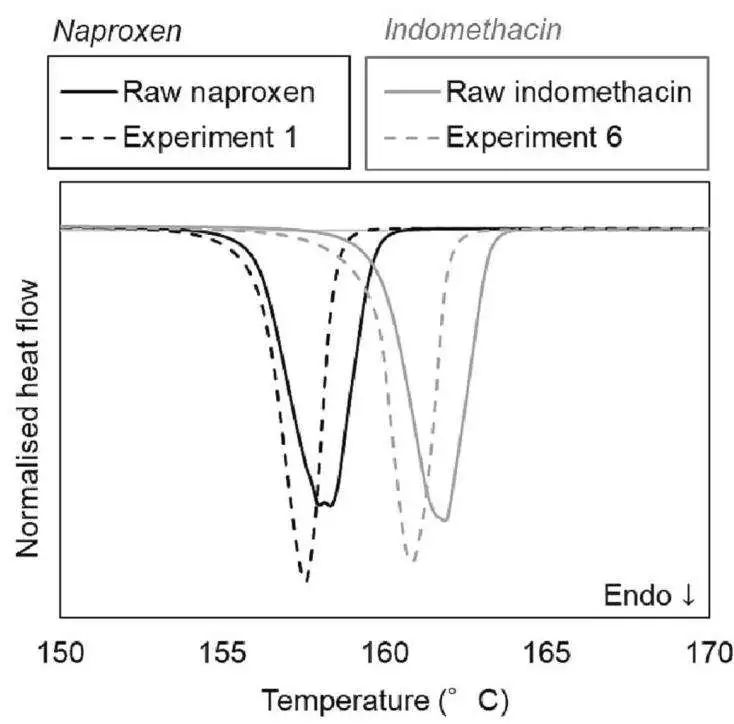
DSC圖
微射流技術
高效粒度減小: 在固定最高壓力(30,000 psi)下,僅需5個循環數(RN=5) 即可將兩種API的懸浮液粒度減小至目標范圍(1-10 μm)。
工藝簡單但有限制: 與氣流粉碎需優化多個參數相比,微射流技術主要通過調節RN來控制粒度,過程更簡單。但其對進料粒度有嚴格要求,導致吲哚美辛原料不得不先經氣流粉碎預處理。
固態形式穩定:與氣流粉碎一樣,微射流技術也未引發API的多晶型轉變。
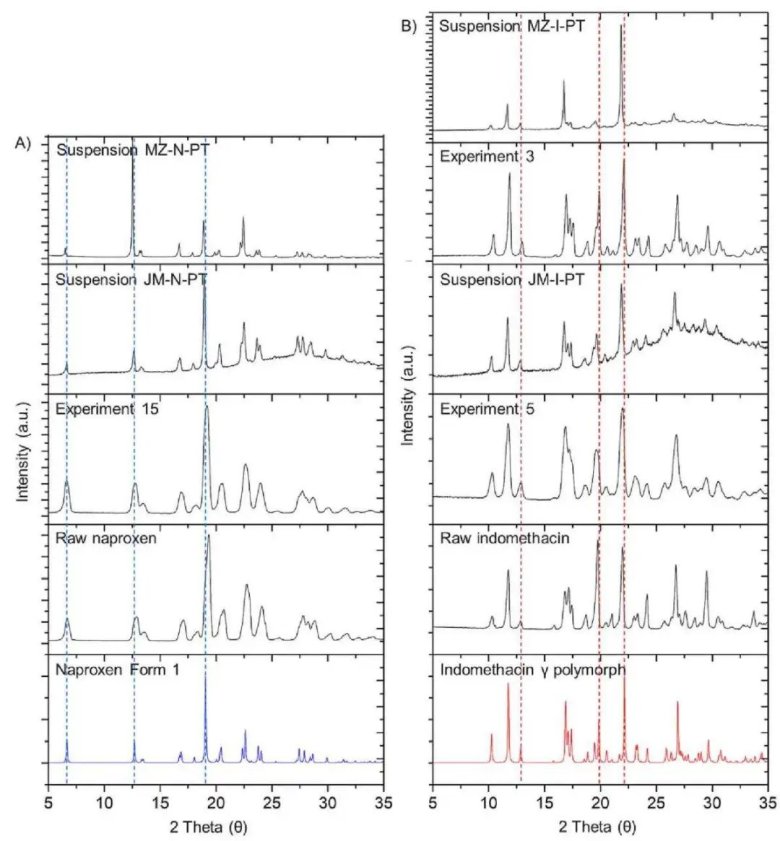
通過氣流粉碎和微流化法制備的(A)萘普生和(B)吲哚美辛顆粒的X射線粉末衍射(XRPD)圖譜
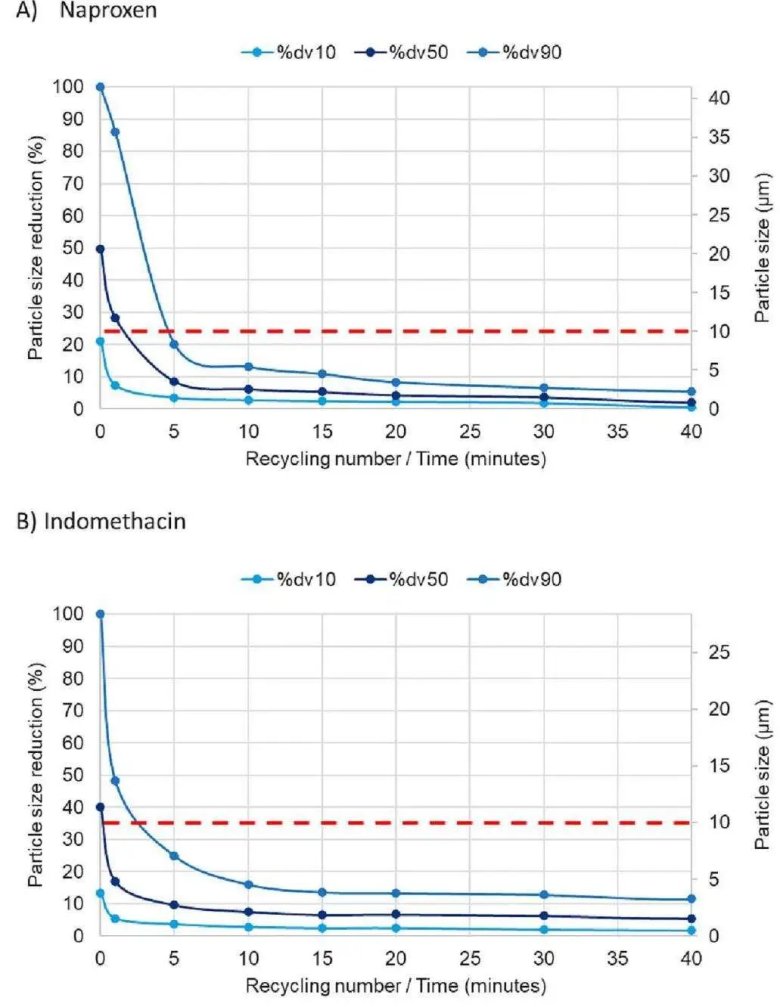
(A)萘普生(B)吲哚美辛,在30000psi下進行,循環次數(RN)為40。紅色虛線表示在1?10μm范圍內達到目標粒度分布所需的最大dv90值
穩定性研究
核心發現:穩定性差異顯著
研究發現,生產技術是影響懸浮液物理穩定性的關鍵因素。
氣流粉碎(JM)懸浮液在所有測試條件下均表現出優異的物理穩定性,粒度(dv10, dv50, dv90)和跨度(Span)隨時間的變化無顯著統計學意義。
微射流(MZ)懸浮液,特別是使用Poloxamer 407/Tween 20穩定的萘普生懸浮液(MZ-N-PT),在所有溫度(5°C, 25°C, 40°C)下均表現出顯著的粒度增長(p-value < 0.05)。
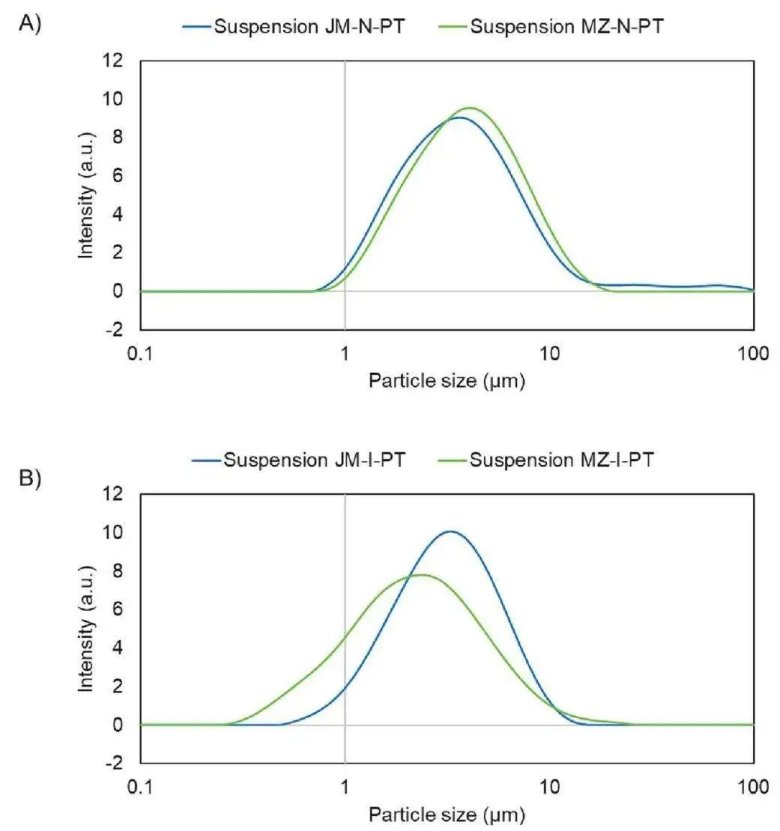
激光衍射測量的(A)萘普生和(B)吲哚美辛顆粒的粒徑分布(PSD)。所示的PSD是針對分別使用氣流粉碎的顆粒構成的顆粒懸浮液(懸浮液JM-N-PT和JM-I-PT)以及使用微射流均質制備的顆粒懸浮液(懸浮液MZ-N-PT和MZ-I-PT)。
關鍵結果與觀察:
微射流懸浮液的問題:
MZ-N-PT懸浮液:在25°C和40°C下,dv10, dv50, dv90均顯著增大;在5°C下,dv50和dv90也顯著增大。
MZ-I-PT懸浮液(吲哚美辛):在25°C和40°C下,dv10顯著增大,且Span(分布寬度)在所有溫度下均顯著變寬,表明粒度分布變得不再均勻。
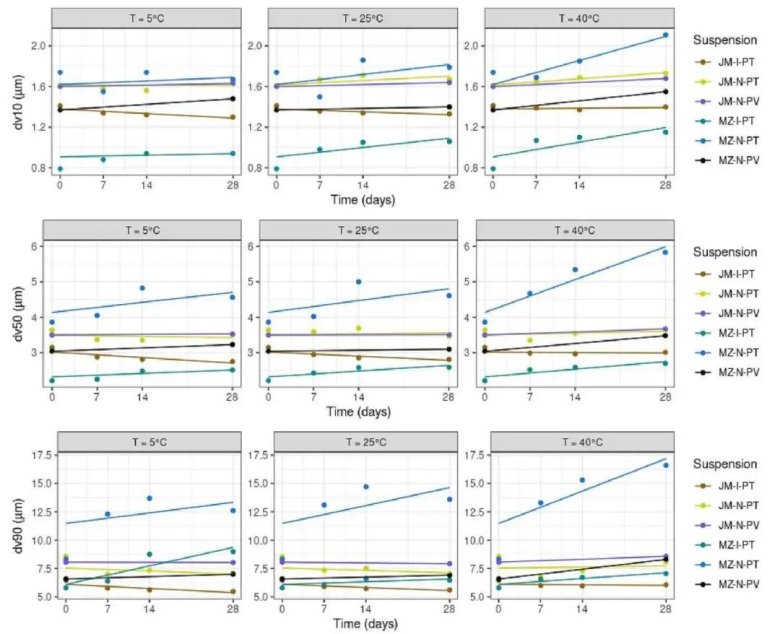
穩定性改進方案:當將萘普生微射流懸浮液的穩定劑更換為PVP K30(即懸浮液 MZ-N-PV)后,粒度增長現象消失,表明穩定劑的選擇對于微射流技術至關重要。
晶型穩定性:所有懸浮液在28天的儲存期內均未發生多晶型轉變,XRPD證實API始終保持其最穩定的晶型。

微射流法制備的萘普生-泊洛沙姆407-吐溫20懸浮液(MZ-N-PT)在制備后立即(第0天)以及在25?C儲存28天后的掃描電子顯微鏡(SEM)圖像
對不穩定機制的分析:
研究對微射流懸浮液不穩定的根本原因進行了探討,提出了幾種可能的機理:
奧斯特瓦爾德熟化 (Ostwald Ripening):微射流更高的能量輸入可能產生亞微米級顆粒(如MZ-I-PT的dv10 < 1 μm)。這些小顆粒溶解度更高,會溶解并重新沉積在大顆粒表面,導致平均粒度增大。輔料可能意外增加了API的溶解度,加劇了這一過程。
表面缺陷與能量:微射流的高能量輸入可能使顆粒產生更多表面缺陷或無序區,這些區域能量更高、更易溶解,為熟化提供了驅動力。
穩定劑解吸:高壓剪切力可能妨礙了穩定劑(Poloxamer 407/Tween 20)在顆粒表面的有效吸附或導致其解吸,從而降低了靜電或空間穩定作用,使得顆粒更容易聚集和生長。
SEM證據支持:對不穩定懸浮液(MZ-N-PT)的SEM成像觀察到了顆粒生長和形態不規則(如團聚體、表面缺陷),為上述機理提供了直觀證據。
六、結論
本研究通過系統比較氣流粉碎(干法)與微射流技術(濕法)制備吲哚美辛和萘普生微粒懸浮液,發現兩種方法雖均能成功制備出1-10 μm且保持藥物穩定晶型的懸浮液,但其關鍵差異在于產品穩定性:氣流粉碎通過精確控制氣體流量與進料速率,所得懸浮液物理穩定性顯著更優,輔料兼容性更廣;而微射流技術雖粒度控制效率高,但其高能量輸入易導致顆粒粗化或奧斯特瓦爾德熟化,穩定性挑戰較大。因此,若目標產品需長期穩定(如長效制劑),氣流粉碎是更可靠的選擇。
參考文獻
[1]Fidel Méndez Caellas, Al-Rifai N , Padrela L ,et al.A comparative study of dry and wet top-down milling approaches for the preparation of microparticle suspensions[J].Powder Technology, 2023, 428.DOI:10.1016/j.powtec.2023.118829.
吸入顆粒制備整體解決方案
微射流均質處理整體解決方案

相關產品
更多
相關文章
更多
技術文章
2025-10-09技術文章
2025-09-15技術文章
2025-08-22技術文章
2025-08-11
虛擬號將在 秒后失效
使用微信掃碼撥號